科创板特供│给生物医药受理企业把把脉
上证报中国证券网讯 擅长“望闻问切”、“治病救人”的生物医药企业,冲刺科创板的第一关,便是被上交所做了一次从头到脚、从里到外的“体检”。
截至5月10日晚,科创板受理企业已经达到108家,其中生物医药行业占24席,占比超过1/5,远超目前的主板和创业板,生物医药未来很有可能成为科创板的前两大行业板块之一。对生物医药类公司的研究,将成为未来科创板投资的重中之重。
那么,该如何对它们进行“望闻问切”呢?
科创板注册制“问询式”审核的亮相,为投资者提供了一种方式。市场对于问询、回复,尤其是对上交所审核中出现的诸多分析、理解、评价的关注度,某些程度上甚至超过了对申报企业招股说明书的关注。
目前,“被体检”的生物医药企业已经达到19家。其中,诺康达、心脉医疗、热景生物、华熙生物、安翰科技、苑东生物、科前生物、南微医学、海尔生物、微芯生物、申联生物、佰仁医疗、特宝生物等公司已回复了第一轮问询。
在上交所目前披露的问询函回复中,记者注意到,监管层普遍关注的业务问题主要涉及行业内竞争对手、专利、技术人员、产品、安全等几大角度。针对财务部分的问题主要涉及营业收入、成本、毛利率、存货、应收账款、政府补助等多个方面。此外,客户、供货商、经销商等相关问题也在问询函中屡次提到。
研发管线
由于药物的特殊性,医学药品从研制到最终转化为产品要经过很多环节:试验室研究阶段、中试生产阶段、临床试验阶段(I、II、III期)、规模化生产阶段、市场商品化阶段,还有监督每个环节的严格复杂的药政审批程序。
在问询中,上交所对多家生物制药企业提到了类似问题。
例如,在对微芯生物的问询函中,上交所对该公司在招股书申报稿中披露的研发管线图提出了更加细化的要求,要求微芯生物从更多维度修改研发管线图中的相关信息。

微芯生物审核问询函回复报告
对于招股书申报稿中未明确研发管线的公司,上交所则要求其补充说明。
如在对华熙生物的问询函中,上交所要求公司结合研发管理情况、研发人员数量、研发团队构成及核心研发人员背景情况、研发投入情况、研发设备情况、技术储备情况等,补充披露现有研发体系是否具备持续创新能力。
而受理企业对于问询函的详细回复,则让市场对于企业的研发能力有了更全面的认识。
例如,微芯生物修改的研发管线图中,就详细说明了新药上市或临床研究申请的适应症。

微芯生物审核问询函回复报告
华熙生物在研发管线的描述中,则详细披露了公司每一个部门的职责、研发人员配备、研发投资投入金额、研发储备/在研项目,并列表详示了在研项目的主要方向及应用前景。
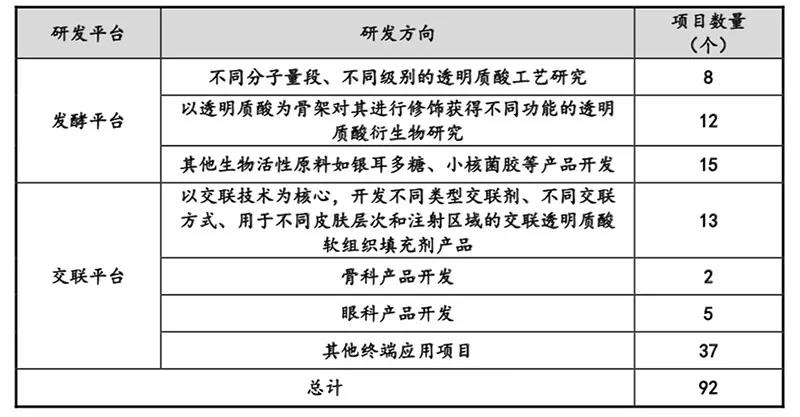
华熙生物审核问询函回复报告
市场容量、竞争格局
所谓外行看热闹,内行看门道。再先进的药品、技术,也需结合市场需求量一同分析,患者流决定市场天花板,竞争格局决定市场份额。
在问询函中,监管部门不仅对行业公司详细追问其市场容量以及同类竞争产品情况,还要求公司详细分析行业已上市和在研的产品,并说明其新上市药物在临床有效性和安全性上相比竞品是否具有明显优势,能够抢占多少市场份额。
在对心脉医疗的问询函中,上交所提出,“我国主动脉介入医疗器械市场规模总体较小,发行人目前产能利用率较低,结合现有产能利用率、产销率及市场容量情况,分析本次扩张主动脉介入医疗器械产能的必要性,是否会造成产能过剩,募投项目达产后新增产能消化的具体措施。”
在对诺康达的问询函中,上交所要求公司披露“药物制剂药学研究领域的市场规模、增长率水平、竞争情况、市场前景及公司的市场占有率、市场排名”。
赛诺医疗则被要求补充披露在研产品的疾病适应症、市场容量、临床需求缺口,是否具有上市的预期时间。
政策壁垒
企业现有产品是否已纳入医保;纳入医保前后销售政策变化及影响;“两票制”政策导致合作方式发生变化对发行人收入和利润的具体影响;仿制药通过一致性评价情况以及行业内可比公司通过情况;新一轮医保目录调整工作启动后,公司药品纳入集中采购目录的中标情况等,这些可能受政策影响的情况同样受到监管部门关注。

微芯生物审核问询函回复报告

赛诺医疗审核问询函回复报告

苑东生物审核问询函回复报告

心脉医疗审核问询函回复报告
监管部门事无巨细地问询,申报企业不惜笔墨地回答,正是通过这种抽丝剥茧的问询式审核,科创板申报企业的重点、焦点问题逐一被揭示,真实状况被呈现。其目的都是为了真正展现受理企业的核心技术和科创含金量,从而为投资者决策提供最有价值的信息。






